技术领域
本发明涉及病毒检测技术领域,尤其是涉及一种2019新型冠状病毒检测引物及检测试剂盒。
背景技术
2020年1月12日,国家卫健委与世界卫生组织分享发现的新型冠状病毒基因序列信息。另外,世界卫生组织总干事谭德塞2月11日在瑞士日内瓦宣布,由2019-nCoV感染导致的疾病的正式名称为COVID-19,其中多数感染会导致肺炎,因而称之为新型冠状病毒肺炎/新冠肺炎。
根据《新型冠状病毒感染的肺炎诊疗方案(试行第五版修正版)》所述,传染源主要是新型冠状病毒肺炎患者,无症状者也可称为传染源。根据目前的证据,可以确定的是,2019-nCoV可以持续人传人。经呼吸道飞沫传播是主要的传播途径,亦可通过接触传播、气溶胶传播,但尚未确定是否可以通过粪-口传播。
针对爆发的疫情,有必要提供一种可用于2019-nCoV的核酸检测试剂来为病毒流行的防控提供技术支撑。
发明内容
本发明旨在至少解决现有技术中存在的技术问题之一。为此,本发明提出一种用于2019新型冠状病毒的检测引物组、探针组及检测试剂盒和检测方法。
第一方面,本发明的一个实施例提供了一种2019新型冠状病毒的检测引物组,包括核苷酸序列如下的三对特异性引物对:
针对2019新型冠状病毒的S基因片段的特异性引物对:
2019-nCovS-F:5′-TGCAGGTATATGCGCTAGT-3′,
2019-nCovS-R:5′-CACCAAGTGACATAGTGTAGG-3′;
针对2019新型冠状病毒的ORF1ab基因片段的特异性引物对:
2019-nCovORF1ab-F:5′-CCCTGTGGGTTTTACACTTAA-3′,
2019-nCovORF1ab-R:5′-ACGATTGTGCATCAGCTGA-3′;
针对2019新型冠状病毒的N基因片段的特异性引物对:
2019-nCovN-F:5′-ATTGGCATGGAAGTCACACC-3′,
2019-nCovN-R:5′-TTATTCAGCAAAATGACTTGAT-3′。
本发明实施例的2019新型冠状病毒检测引物组至少具有如下有益效果:
三对特异性引物对分别针对2019新型冠状病毒的S基因、ORF1ab基因和N基因的高度保守区进行特异性引物的设计,在这之中,ORF1ab的同源性较低,可作为区分2019新型冠状病毒与其它冠状病毒的重要靶位;而在2019新型冠状病毒的结构蛋白中,N蛋白最为保守和稳定,检测序列特异性的N基因的片段可进一步辅助诊断2019新型冠状病毒的感染。同时,由于这两个基因出现的假阴性较高,增加了特异性更强的S基因进行引物的设计,从而降低了假阴性率。通过这三对特异性引物的设计,提高对2019新型冠状病毒检测的准确性和精密度。
第二方面,本发明的一个实施例提供了一种与上述2019新型冠状病毒的检测引物组相配合使用的探针组,包括以下探针:
针对2019新型冠状病毒的S基因片段的探针:
2019-nCovS-P:5′-CGACTAATTCTCCTCGGCGGG-3′;
针对2019新型冠状病毒的ORF1ab基因片段的探针:
2019-nCovORF1ab-P:5′-CCGTCTGCGGTATGTGGAAAGGTTA-3′;
针对2019新型冠状病毒的N基因片段的探针:
2019-nCovN-P:5′-AGTTGACCTACACAGGTGCCATC-3′;
其中,上述三个探针的5′端均标记有荧光报告基团,3′端均标记有荧光淬灭基团。
在PCR扩增过程中,当探针完整时,由于荧光淬灭基团靠近荧光报告基团,荧光报告基因发出的荧光被淬灭基团吸收,不发出荧光信号。而在引物延伸时,与模板结合的探针被Taq酶(5'→3'外切核酸酶活性)切断,荧光报告基团与荧光淬灭基团分离,产生荧光信号,荧光定量PCR仪根据检测到的荧光信号自动绘制出实时扩增曲线,从而实现对2019新型冠状病毒(2019-nCovORF1ab、N、S片段)在核酸水平上的检测。检测结果可选择定性或定量,直接判断是否存在相应的扩增曲线可实现定性检测。根据不同浓度梯度标准品的Ct值绘制相应的标准曲线,以样本的Ct值进行计算可以获得定量结果。另外,基于本领域的一般理解,不同探针的荧光报告基团应不同,以使单管反应时不同基因片段的扩增产生不同波段的荧光信号方便检测。
根据本发明的一些实施例的探针组,2019-nCovS-P的5′端标记有荧光报告基团JOE,3′端标记有荧光淬灭基团BHQ1;2019-nCovORF1ab-P的5′端标记有荧光报告基团CY5,3′端标记有荧光淬灭基团BHQ2;2019-nCovN-P的5′端标记有荧光报告基团FAM,3′端标记有荧光淬灭基团BHQ1。
第三方面,本发明的一个实施例提供了一种2019新型冠状病毒的检测试剂盒,该试剂盒包括上述引物组和上述探针组。
根据本发明的一些实施例的检测试剂盒,还包括内标引物对和内标探针;
其中,内标引物对的核苷酸序列如下:
RNP-F:5′-AGATTTGGACCTGCGAGC-3′,
RNP-R:5′-GCGGCTGTCTCCACAAGT-3′;
内标探针RNP-P的核苷酸序列如下:5′-CTGACCTGAAGGCTCTGCGC-3′;
内标探针RNP-P的5′端标记有荧光报告基团,3′端标记有荧光淬灭基团。
试剂盒所用内标为人核糖核苷酸酶P(RNaseP),通过内标判断是否取到了合格的患者组织或分泌物标本,对待测样本的采集、运输和提取的整个实验过程进行监控,避免检测结果的假阴性。
内标探针的荧光报告基团同样应采取与前述检测探针的荧光报告基团不同的基团,例如,选择ROX,同时荧光淬灭基团选择BHQ1,如此,可在ROX通道检测荧光。
根据本发明的一些实施例的检测试剂盒,还包括RT-PCR酶混合液和RT-PCR缓冲液。
根据本发明的一些实施例的检测试剂盒,还包括阳性对照品和阴性对照品。阳性对照品应当在扩增过程中能够完全扩增出引物对应的靶向基因片段,例如,可以是灭活的标准毒株、包含该病毒引物探针相应的靶向基因片段(S基因片段、ORFlab基因片段、N基因片段)的质粒、假病毒等。阴性对照品为用于溶解模板RNA的水,例如可以是DEPC水。
根据本发明的一些实施例的检测试剂盒,还包括核酸提取试剂。通过相应的核酸提取试剂完成对样本中病毒核酸的提取以方便后续扩增检测程序的进行。
第四方面,本发明的一个实施例提供了一种2019新型冠状病毒的检测方法,该检测方法包括以下步骤:
提取待测样本的总RNA;
以样本的总RNA为模板,利用上述的检测引物组和探针组进行扩增;
分析扩增产物,根据是否出现扩增曲线,判断待测样本中是否含有2019新型冠状病毒;
该检测方法不适用于疾病的诊断与治疗。
根据本发明的一些实施例的检测方法,PCR扩增反应的程序为50℃,20min;95℃,15min;95℃,10s,55℃,40s,40个循环。
实时荧光RT-PCR方法从核酸的提取到完成检测,全程仅需3h而且操作方便,特异性强,灵敏度高,极大程度上缩短了2019新型冠状病毒的检测时间,为暴发疫情的实验室应急诊断提供了一种快速、有效的实验室检测方法。
采用荧光PCR方法在排除样本质量、样本收集时机、污染和技术问题的情况下,从咽拭子或其他呼吸道样本中检测出2019-nCoV的RNA,尤其多次、多种标本和多种检测试剂盒的2019-nCoV的RNA阳性,对病原学诊断有重要支持意义。
三对特异性引物对分别针对2019新型冠状病毒的S基因、ORF1ab基因和N基因的高度保守区进行特异性引物的设计,在这之中,ORF1ab的同源性较低,可作为区分2019新型冠状病毒与其它冠状病毒的重要靶位;而在2019新型冠状病毒的结构蛋白中,N蛋白最为保守和稳定,检测序列特异性的N基因的片段可进一步辅助诊断2019新型冠状病毒的感染。同时,由于这两个基因出现的假阴性较高,增加了特异性更强的S基因进行引物的设计,从而降低了假阴性率。通过这三对特异性引物的设计,提高对2019新型冠状病毒检测的准确性和精密度。
利用前述试剂盒的上述检测方法可用于2019新型冠状病毒的辅助诊断,快速获得关于2019新型冠状病毒爆发的流行病学信息,为2019新型冠状病毒流行的防控提供可靠的技术支撑,在应对今后未知2019新型冠状病毒爆发流行方面具有重要意义。
附图说明
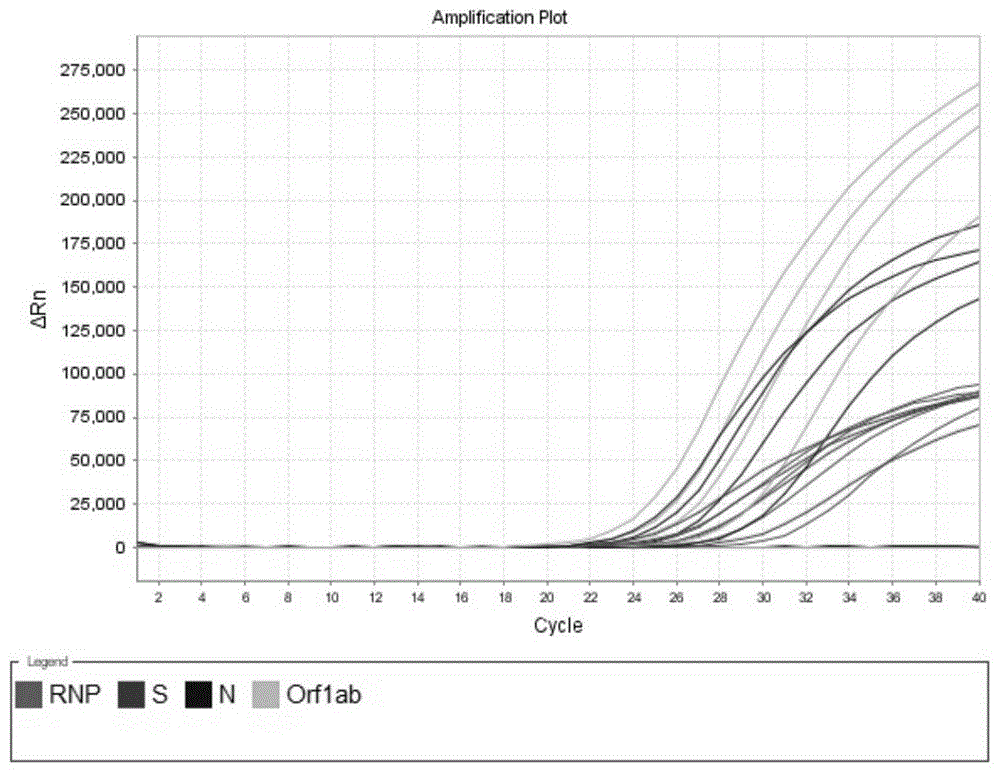
图1是本发明的实施例3的2019新型冠状病毒多重PCR检测试剂盒的扩增结果。
图2是本发明的实施例4的2019新型冠状病毒多重PCR检测试剂盒的灵敏度检测结果。
图3是本发明的实施例5的2019新型冠状病毒多重PCR检测试剂盒的重复性检测结果。
图4是本发明的实施例6的2019新型冠状病毒多重PCR检测试剂盒的梯度检测结果。
图5是本发明的实施例6的对照组的三种2019新型冠状病毒单重PCR检测试剂盒的梯度检测结果。
图6是本发明的实施例7的2019新型冠状病毒多重PCR检测试剂盒的梯度检测结果。
图7是本发明的实施例7的对照组的梯度检测结果。
具体实施方式
以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
实施例1
本实施例提供一种2019新型冠状病毒的引物和探针。基于Taqman荧光探针技术,以2019新型冠状病毒的S基因、ORF1ab基因和N基因的高度保守区设计相应的特异性检测引物及Taqman探针,同时,以人核糖核苷酸酶P(RNaseP)作为内标,设计相应的内标引物对和内标探针。具体如下表1所示:
表1.引物和探针信息

其中,2019-nCovS-P的5′端标记有荧光报告基团JOE,3′端标记有荧光淬灭基团BHQ1;2019-nCovORF1ab-P的5′端标记有荧光报告基团CY5,3′端标记有荧光淬灭基团BHQ2;2019-nCovN-P的5′端标记有荧光报告基团FAM,3′端标记有荧光淬灭基团BHQ1;RNP-P的5′端标记有荧光报告基团ROX,3′端标记有荧光淬灭基团BHQ1。
实施例2
本实施例提供一种2019新型冠状病毒检测试剂盒,包括RT-PCR酶混合液、RT-PCR缓冲液、RT-PCR引物混合液、RT-PCR探针、RT-PCR阳性对照品、RT-PCR阴性对照品。
其中,RT-PCR酶混合液包括2-3U/μL热启动Taq酶、1-2U/μL逆转录酶、15-30mMTris、10%-30%甘油、0.5-1.5mMDTT;
RT-PCR缓冲液包括250mMTris、25mMMgCl2、50mMKCl、0.025%TritonX-100组成的缓冲体系以及6.5mMdNTPs;
RT-PCR引物混合液和RT-PCR探针为实施例1中的引物和探针;
RT-PCR阳性对照品为以pUC57为质粒载体的2019新型冠状病毒S基因、ORF1ab基因和N基因及内标基因的引物靶向片段的质粒溶液。
RT-PCR阴性对照品为DEPC水。
实施例3
本实施例提供一种2019新型冠状病毒的检测方法,包括以下步骤:
1.核酸的提取
获取咽拭子待测样本,灭活处理(56℃加热30min)后按照提取试剂盒的方法进行提取,本实施例中采用深圳市梓健生物科技有限公司生产的核酸提取或纯化试剂(备案号:粤深械备20180040号)。
2.PCR扩增
按照表2配置RT-PCR反应液体系:
表2.RT-PCR反应液体系
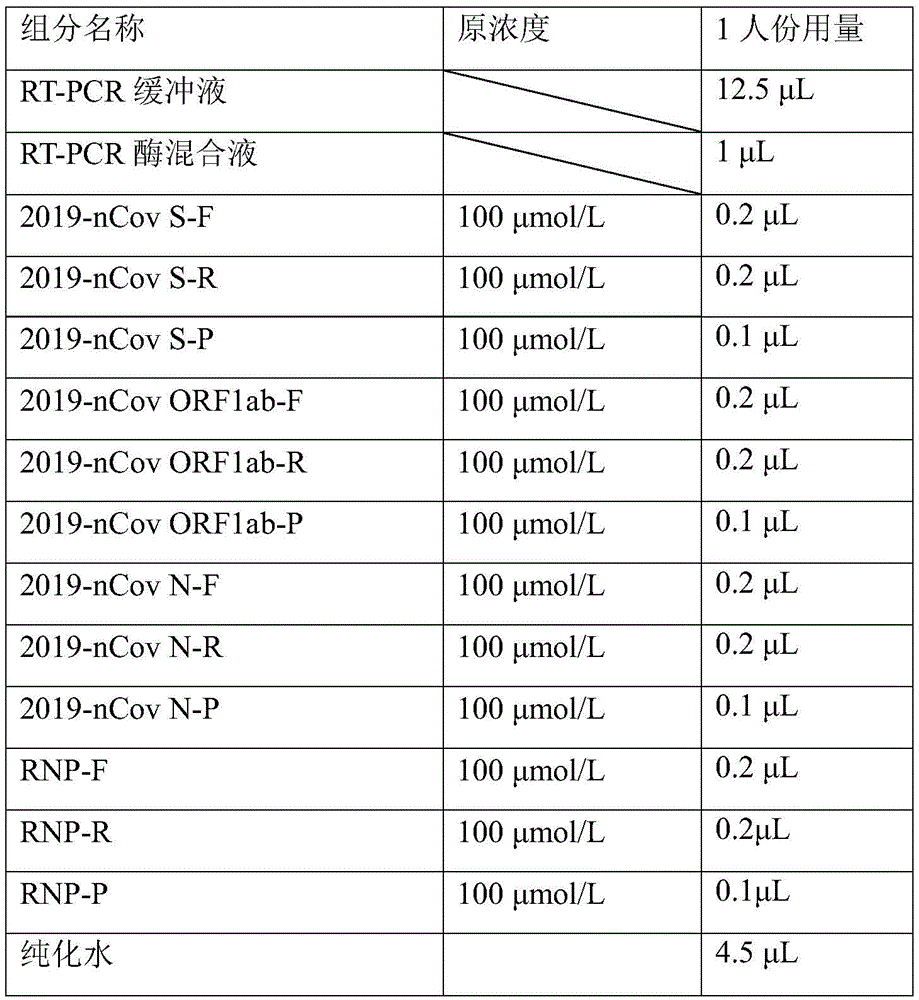
其中,RT-PCR酶混合液、RT-PCR缓冲液为实施例2中的RT-PCR酶混合液、RT-PCR缓冲液。
以步骤1提取的RNA为模板,加入5μL到上述反应液体系,在ABI7500仪器上进行多重荧光PCR扩增反应,扩增反应的程序如下:50℃,20min;95℃,15min;95℃,10s,55℃,40s,40个循环。
3.结果判断
设置基线和阈值线,基线一般为3~15个循环,阈值线为刚好超过阴性对照品的最高点。
阳性对照品需满足JOE、FAM、CY5、ROX通道均有明显的S型扩增曲线;阴性对照品需满足其它通道无扩增曲线;同时满足上述条件方可对待测样本结果进行分析。
若JOE、FAM、CY5通道任意两个通道检测到有明显的S型扩增曲线,表明待测样本中含有2019新型冠状病毒,只有一个通道检测到有明显的S型扩增曲线,需重新检测。
图1是本发明的实施例3的2019新型冠状病毒多重PCR检测试剂盒的扩增结果。从图中可以看出,JOE、FAM、CY5通道有明显的S型扩增曲线,表明该样本中含有2019新型冠状病毒。
实施例4
灵敏度检测
将已标定的1×108copies/mL的人工合成的含2019新型冠状病毒ORF1ab、N和S片段的RNA分别稀释到1×107copies/mL、1×106copies/mL、1×105copies/mL、1×104copies/mL、1×103copies/mL,以此梯度用实施例3中的扩增反应体系进行灵敏度测试,扩增结果如图2所示。图2是本发明的实施例4的2019新型冠状病毒多重PCR检测试剂盒的灵敏度检测结果。从图2中可以看出,JOE、FAM、CY5通道以及检测内标的ROX通道均有明显的5道S型扩增曲线,表明该试剂盒的灵敏度可达到1000copies/mL,Ct值可达37。
实施例5
重复性检测
以1×104copies/mL的实施例4中的RNA溶液为样本,进行10次重复扩增实验,结果如图3所示,图3是本发明的实施例5的2019新型冠状病毒多重PCR检测试剂盒的重复性检测结果。从图中可以看到,试剂盒的重复性较高,经计算,Ct值的CV%小于5%。
实施例6
多重与单重比较
以深圳市梓健生物科技有限公司研制的“新型冠状病毒(2019-nCov)N基因核酸检测试剂盒(荧光PCR法)”、“新型冠状病毒(2019-nCov)S基因核酸检测试剂盒(荧光PCR法)”、“新型冠状病毒(2019-nCov)ORF1ab基因核酸检测试剂盒(荧光PCR法)”和实施例3中的反应体系做对比实验,同时检测5个不同浓度的2019新型冠状病毒核酸样本。
对比实验结果如图4和图5所示,图4是本发明的实施例6的2019新型冠状病毒多重PCR检测试剂盒的梯度检测结果。图5是本发明的实施例6的对照组的三种2019新型冠状病毒单重PCR检测试剂盒的梯度检测结果。结合图4和图5进行比较可以看出,本发明实施例所提供的多重PCR检测试剂盒对阳性样本的扩增效果与单重试剂盒的扩增效果具有一致性。
实施例7
与其它公司的产品比较
本实施例以天隆生物科技有限公司研制的新型冠状病毒(2019-nCov)ORF1ab基因核酸检测试剂盒(荧光PCR法)、新型冠状病毒(2019-nCov)N基因核酸检测试剂盒(荧光PCR法)、新型冠状病毒(2019-nCov)S基因核酸检测试剂盒(荧光PCR法)作为对照组,将其与实施例3所提供的反应体系做检测对比实验,同时检测5个不同浓度新型冠状病毒核酸样本,按照试剂盒说明书与上机程序进行样本检测扩增,扩增结果如图6和图7所示。图6是本发明的实施例7的2019新型冠状病毒多重PCR检测试剂盒的梯度检测结果。图7是本发明的实施例7的对照组的梯度检测结果。经检测样本扩增曲线对比,实施例3所提供的反应体系检测出的低浓度阳性样本的扩增效果比天隆生物科技公司检测出的同一样本的Ct值靠前2个,这表明本发明实施例所提供的检测试剂盒检测出的灵敏度比对照组更高,试剂扩增样本效果好。
上面结合附图对本发明实施例作了详细说明,但是本发明不限于上述实施例,在所述技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
SEQUENCELISTING
<110>深圳市梓健生物科技有限公司
<120>2019新型冠状病毒的检测引物组、探针组及检测试剂盒
<130>1
<160>12
<170>PatentInversion3.5
<210>1
<211>19
<212>DNA
<213>人工序列
<400>1
tgcaggtatatgcgctagt19
<210>2
<211>21
<212>DNA
<213>人工序列
<400>2
caccaagtgacatagtgtagg21
<210>3
<211>21
<212>DNA
<213>人工序列
<400>3
cgactaattctcctcggcggg21
<210>4
<211>21
<212>DNA
<213>人工序列
<400>4
ccctgtgggttttacacttaa21
<210>5
<211>19
<212>DNA
<213>人工序列
<400>5
acgattgtgcatcagctga19
<210>6
<211>25
<212>DNA
<213>人工序列
<400>6
ccgtctgcggtatgtggaaaggtta25
<210>7
<211>20
<212>DNA
<213>人工序列
<400>7
attggcatggaagtcacacc20
<210>8
<211>22
<212>DNA
<213>人工序列
<400>8
ttattcagcaaaatgacttgat22
<210>9
<211>23
<212>DNA
<213>人工序列
<400>9
agttgacctacacaggtgccatc23
<210>10
<211>18
<212>DNA
<213>人工序列
<400>10
agatttggacctgcgagc18
<210>11
<211>18
<212>DNA
<213>人工序列
<400>11
gcggctgtctccacaagt18
<210>12
<211>20
<212>DNA
<213>人工序列
<400>12
ctgacctgaaggctctgcgc20




 手机二维码
手机二维码 京公网安备11011302007134
京公网安备11011302007134