(一)技术领域
本发明涉及一株新的姜黄素转化菌株----库德里阿兹威毕赤酵母 (P ichia kudriavzevii) ZJPH0802,及其在微生物转化制备姜黄素衍 生物中的应用。
(二)背景技术
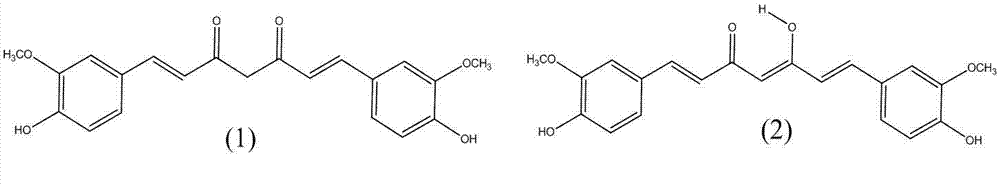
姜黄素为橙黄色结晶粉末,味稍苦,难溶于水,溶于乙醇、丙二醇等 有机溶剂,易溶于冰醋酸和碱性溶液,在碱性时呈红褐色,在中性和 酸性时呈黄色,是一种疏水性多酚化合物,有一个特殊的1,7-二芳基 庚烷的基本骨架,由两个邻甲基化的酚及一个β-二酮组成,分子式为 C21H20O6。其中β-二酮结构有烯醇-酮互变异构,在酸性和中性溶液中 主要以酮式(1)结构存在,而在碱性溶液中主要以烯醇式(2)结构稳定 存在。
姜黄素的化学结构式为:
姜黄素具有抗氧化、抗炎、降血脂、抗动脉粥样硬化、抗癌、抗HIV等 生物活性,可用于治疗皮肤病、糖尿病、风湿性关节炎、囊胞性纤维 症、艾滋病和多种癌症等,且其分子量小、毒性低,具有良好的临床 应用潜力。但姜黄素的水溶性差、结构不稳定,使其在食品和医药领 域中的应用受到限制,其选择性低、药效不持久、被机体吸收的能力 差,导致其生物利用度低,这些不足限制了其临床应用。目前许多学 者合成了较多的姜黄素衍生物与类似物,并对它们的理化性质和生物 活性进行检测和评价,但利用微生物细胞转化方法对姜黄素进行结构 修饰的报道较少。Xing Zhang等 采用在华根霉(Rhizopus chinensis)培养液中直接加入姜黄素的生长 培养转化法得到姜黄素衍生物(Biocatalysis and Biotransforma tion, September–December 2010; 28(5–6): 380–386)。本发 明采用库德里阿兹威毕赤酵母静息细胞转化方法,不仅有效提高了转 化率,还可有效地控制转化液的组成,以适应底物转化的最佳条件; 同时减少培养基成分对生物转化过程的影响,便于转化产物的后续分 离与提纯。本发明的菌种易培养,含酶源细胞的制备成本低,并且姜 黄素底物的转化反应时间可大大缩短。采用生物转化法进行天然产物 的结构修饰具有选择性好、特异性强等优点,且生物体系可产生多种 性质与功能各异的酶,从而可催化姜黄素底物转化生成具有不同取代 方式的系列衍生物,有望从中找到活性更好或具有新结构的化合物, 对于研究此类化合物的“构效关系”具有重要意义。
(三)发明内容
本发明目的是提供一株新的姜黄素微生物转化菌株-----库德里阿兹威 毕赤酵母(Pichia kudriavzevii) ZJPH0802,以及利用该菌株转化 制备姜黄素衍生物的方法。
本发明采用的技术方案是:
本发明提供一株新的姜黄素微生物转化菌株-----库德里阿兹威毕赤酵 母ZJPH0802 (Pichia kudriavzevii ZJPH0802),保藏于中国典型 培养物保藏中心,地址:中国武汉·武汉大学,保藏日期:2012年9月 24日,保藏编号:CCTCC M 2012373。
菌种来源:库德里阿兹威毕赤酵母(Pichia kudriavzevii) ZJPH08 02菌株系从采自杭州市浙江工业大学(朝晖校区)土样中分离筛选获 得。
所述库德里阿兹威毕赤酵母(Pichia kudriavzevii) ZJPH0802按如 下步骤筛选获得:
土样采集→平板培养→菌种分离→斜面培养→种子培养→
发酵培养 →生物转化反应→液相色谱检测产物→获得目的菌株
所述库德里阿兹威毕赤酵母ZJPH0802菌株的特征如下:
菌落形态:麦芽汁平板上30℃培养48 h,菌落呈不规则形状,乳白色 ,表面干燥,粗糙,疏松,扁平,边缘呈锯齿状。
细胞形态:卵圆型或香肠型、周边出芽,有假菌丝,1~2个子囊孢子。
生理生化特征:可以利用的碳源有:D-葡萄糖、L-乳酸、琥珀酸、乙 醇。不能利用的碳源有:D-木糖、L-阿拉伯糖、松三糖、麦芽糖、淀 粉、木糖醇、纤维二糖、D-半乳糖、L-鼠李糖、水杨苷、L-山梨糖。 可以利用的氮源有:L-赖氨酸、乙胺。不能利用的氮源有:硝酸盐、 亚硝酸盐、肌酸、肌酸酐。
鉴定:该菌种的26S rDNA D1/D2区序列特性:以提取到的细胞总DN A为模板,利用通过引物NL1和NL4扩增菌株的26S rDNA D1/D2区的基 因,再将PCR产物进行1%的琼脂糖凝胶电泳。经测序确认所述库德里阿 兹威毕赤酵母(Pichia kudriavzevii) ZJPH0802的26S rDNA D1/ D2区序列如下:GCGGAGGAAAAGAAACCAACAGGGATTGCCTCAGTAGCGGCGAGTG AAGCGGCAAGAGCTCAGATTTGAAATCGTGCTTTGCGGCACGAGTTGTAGATTGCAGGTT GGAGTCTGTGTGGAAGGCGGTGTCCAAGTCCCTTGGAACAGGGCGCCCAGGAGGGTGAGA GCCCCGTGGGATGCCGGCGGAAGCAGTGAGGCCCTTCTGACGAGTCGAGTTGTTTGGGAA TGCAGCTCCAAGCGGGTGGTAAATTCCATCTAAGGCTAAATACTGGCGAGAGACCGATAG CGAACAAGTACTGTGAAGGAAAGATGAAAAGCACTTTGAAAAGAGAGTGAAACAGCACGT GAAATTGTTGAAAGGGAAGGGTATTGCGCCCGACATGGGGATTGCGCACCGCTGCCTCTC GTGGGCGGCGCTCTGGGCTTTCCCTGGGCCAGCATCGGTTCTTGCTGCAGGAGAAGGGGT TCTGGAACGTGGCTCTTCGGAGTGTTATAGCCAGGGCCAGATGCTGCGTGCGGGGACCGA GGACTGCGGCCGTGTAGGTCA CGGATGCTGGCAGAACGGCGCAACACCGCCCGTC
该序列已提交GenBank(GenBank登录号为No.KC143811),将ZJPH08 02菌株的26S rDNA D1/D2区序列在 NCBI 网站(http://www.ncb i.nlm.nih.gov)上进行同源性比对(BLAST),结果表明:ZJPH0802 菌株与毕赤酵母属(Pichia sp.)的部分菌株序列同源性较高。ZJP H0802菌株与Pichia kudriavzevii DMic 113897菌株(GenBank登 录号为No.JN032661.1)的序列同源性达到100%。
根据生理生化特性并结合分子生物学鉴定,该菌株被鉴定为库德里阿 兹威毕赤酵母,命名为库德里阿兹威毕赤酵母(Pichia kudriavzevi i) ZJPH0802。
本发明还涉及所述库德里阿兹威毕赤酵母ZJPH0802在生物转化制备姜 黄素衍生物中的应用,所述的应用为:以库德里阿兹威毕赤酵母ZJPH 0802发酵培养获得的湿菌体为酶源,以姜黄素为底物,于磷酸缓冲液 介质中进行转化反应,反应结束后将转化反应液进行后处理,获得所 述姜黄素衍生物。
通常,所述磷酸缓冲液为pH值5.8~8.0磷酸缓冲液。
进一步,所述转化反应液的后处理方法为:反应结束后,将转化液离 心,取上清液用乙酸乙酯萃取,将萃取液减压蒸馏除去乙酸乙酯,取 残留物进行硅胶柱层析,TLC跟踪检测,收集Rf值为0.424或0.712时的 洗脱液,蒸除溶剂,获得所述姜黄素衍生物。
进一步,所述库德里阿兹威毕赤酵母ZJPH0802在生物转化制备姜黄素 衍生物中的应用优选按下述方法进行:在酶源细胞,姜黄素,磷酸缓 冲液构成的转化体系中,以库德里阿兹威毕赤酵母ZJPH0802发酵培养 获得的湿菌体为酶源,以姜黄素为底物,于pH值为5.8~8.0磷酸缓冲液 的转化体系中,在20~40℃、150~220 rpm条件下进行转化反应,反应 结束后,将转化反应液离心,取上清液用乙酸乙酯萃取,将萃取液减 压蒸馏除去乙 酸乙酯,取残留物进行硅胶柱层析,TLC跟踪检测,收集Rf值为0.424 或0.712的洗脱液,蒸除溶剂,获得所述姜黄素衍生物。
进一步,所述库德里阿兹威毕赤酵母ZJPH0802发酵培养获得的湿菌体 的用量以菌体干重计为20~150 g/L转化体系,所述姜黄素底物的初始 浓度为20~250 mg/L转化体系。
更进一步,所述库德里阿兹威毕赤酵母ZJPH0802发酵培养获得的湿菌 体的用量以菌体干重计为20~100 g/L转化体系,所述底物的初始浓度 为20~180 mg/L转化体系,转化反应时间为2~24 h。
最优,酶源,底物,置于pH值为5.8~8.0磷酸缓冲液中构成转化体系, 转化温度为30℃,摇床转速为200 rpm,转化反应时间为16 h。
进一步,所述酶源按如下方法制备:
(1)斜面培养:将库德里阿兹威毕赤酵母ZJPH0802接种至斜面培养基 ,30℃培养2~3天,获得斜面菌体,所述斜面培养基的终浓度组成为每 升麦芽汁中加入20 g琼脂,自然pH值;
(2)种子培养:从斜面菌体挑选一环菌体接种至种子培养基中,在3 0℃、200 rpm培养16 h,获得种子液;所述种子培养基终浓度组成 为:葡萄糖15~40 g/L、酵母膏1~3 g/L、NH4Cl 3~8 g/L、MgSO4·7H2O 0.1~0.5 g/L、KH2PO4 0.2~1.5 g/L、K2HPO4 0.2~1.5 g /L,pH 5~8,溶剂为水;
(3)发酵培养:以体积浓度5~15%接种量将种子液接种到发酵培养基 中,30℃、200 rpm发酵培养24 h,将发酵培养液离心,收集湿菌体 ,即获得所述酶源;所述发酵培养基终浓度组成同步骤(2)所述种子 培养基终浓度组成。
本发明所述酶源制备过程中用于发酵培养的培养基优选为:葡萄糖25 ~35 g/L、酵母膏1.5~2.5 g/L、NH4Cl 5.5~6.5 g/L、MgSO4·7H 2O 0.3~0.5 g/L、KH2PO4 0.5~1.2 g/L、K2HPO4 0.5~1.2 g/L, pH 5~8,溶剂为水,最优 选为葡萄糖25 g/L,酵母膏2.5 g/L,NH4Cl 5.5 g/L,MgSO4.7H 2O 0.4 g/L,KH2PO4 1g/L、K2HPO4 1g/L,pH 6.5,溶剂为水。
进一步,所述库德里阿兹威毕赤酵母ZJPH0802在生物转化制备姜黄素 衍生物中应用,具体为转化制备六氢姜黄素的应用按如下步骤进行: 将库德里阿兹威毕赤酵母ZJPH0802发酵培养获得的湿菌体和姜黄素置 于pH值为6.2~7.4磷酸缓冲液中构成转化体系,在30℃、200 rpm条件 下进行转化反应16 h,反应结束后,将转化液离心,取上清液用乙酸 乙酯萃取三次,合并所有萃取液,减压浓缩至干除去乙酸乙酯,取残 留物用色谱甲醇溶解后进行硅胶柱层析,以体积比100:1的二氯甲烷和 甲醇混合液为洗脱剂,TLC法跟踪检测,收集Rf值为0.712时的洗脱液 ,将洗脱液于80℃下水浴蒸除溶剂,获得所述姜黄素衍生物,即六氢 姜黄素;所述库德里阿兹威毕赤酵母ZJPH0802发酵培养获得的湿菌体 的用量以菌体干重计为20~100 g/L转化体系,所述姜黄素底物的初始 浓度为20~180 mg/L转化体系。
进一步,所述库德里阿兹威毕赤酵母ZJPH0802在生物转化制备姜黄素 衍生物中应用,具体为转化制备四氢姜黄素的应用按如下步骤进行: 将库德里阿兹威毕赤酵母ZJPH0802发酵培养获得的湿菌体和姜黄素置 于pH值为6.2~7.4磷酸缓冲液中构成转化体系,在30℃、200 rpm条件 下进行转化反应16 h,反应结束后,将转化液离心,取上清液用乙酸 乙酯萃取三次,合并所有萃取液,减压浓缩至干除去乙酸乙酯,取残 留物用色谱甲醇溶解后进行硅胶柱层析,以体积比50:1的二氯甲烷和 甲醇混合液为洗脱剂,TLC法跟踪检测,收集Rf值为0.424的洗脱液, 将洗脱液于80℃下水浴蒸除溶剂,获得所述姜黄素衍生物,即四氢姜 黄素;所述库德里阿兹威毕赤酵母ZJPH0802发酵培养获得的湿菌体的 用量以菌体干重计为20~100 g/L转化体系,所述姜黄素底物的初始浓 度为20~180 mg/L转化体 系。
本发明所述经库德里阿兹威毕赤酵母ZJPH0802湿菌体生物转化后获得 的转化反应液(实验组),首先进行TLC法分析,与姜黄素标准品、对 照组1(转化反应体系中只加入底物,不加入酶源,用缓冲液补充体积 )和对照组2(转化反应体系中不加入底物,只加入酶源,用缓冲液补 充体积)进行对照,确定实验组的转化液是否产生新斑点,如果产生 新的斑点,则将转化液离心,取上清液用乙酸乙酯萃取,将萃取液减 压浓缩至干,取浓缩物用色谱甲醇溶解、微滤(0.45 μm)处理后进 行HPLC分析,确定是否出现新的特征峰(与姜黄素标准品、对照组1和 对照组2相比)。如果出现新的特征峰,将生物转化后获得的转化液离 心,取上清液用乙酸乙酯萃取,将萃取液减压浓缩后进行硅胶柱层析 ,收集Rf值为0.712的流出液,除去洗脱剂,获得所述姜黄素衍生物之 一;收集Rf值为0.424的流出液,除去洗脱剂,获得所述姜黄素衍生物 之二。分别采用高效液相色谱法分析其纯度。取纯度在95%以上的组分 进行高效液相色谱和质谱联用检测(LC-MS),1H-NMR和13C-NMR检测, 鉴定其结构。
本发明有益效果主要体现在:本发明提供了一株生物转化制备姜黄素 衍生物的新菌株-----库德里阿兹威毕赤酵母ZJPH0802,并利用该菌株 静息细胞转化方法对姜黄素进行结构修饰,由此获得相应的衍生物。 姜黄素结构修饰物的药理或生物活性较修饰前的姜黄素底物有不同程 度的改善,有利于药物新制剂的开发;本发明采用微生物转化方法获 得姜黄素衍生物的工艺较简单,环境友好,生物催化剂为微生物菌体 ,可以自行发酵生产,质量稳定,成本低廉。
(四)附图说明
图1 本发明利用库德里阿兹威毕赤酵母ZJPH0802微生物转化制备姜黄 素衍生物的流程图。
图2实施例1姜黄素转化产物的TLC图谱示意图:1为对照组2样品,2为 实验组样品,3为对照组1样品,4为姜黄素标准品; a,b为库德里阿 兹威毕赤酵母ZJPH0802菌株的姜黄素转化产物产生的斑点;c为对照组 1样品产生的斑点;d为姜黄素标准品的斑点。
图3实施例1姜黄素转化产物的HPLC图谱:a为姜黄素标准品;b为对照 组1样品;c为实验组样品;d为对照组2样品;峰1-峰6对应的时间分别 为t1=23 min,t2=25 min,t3=26 min,t4=27 min,t5=54min, t6=62 min,t姜黄素=66 min。
图4实施例1姜黄素转化产物3(t=26 min)的一级质谱图(MS)。
图5实施例1姜黄素转化产物3(t=26 min)的三级质谱图(MS3)。
图6实施例1姜黄素转化产物3(t=26 min)的核磁氢谱图(1H-NMR)。
图7实施例1姜黄素转化产物6(t=62 min)的一级质谱图(MS)。
图8实施例1姜黄素转化产物6(t=62 min)的三级质谱图(MS3)。
图9实施例1姜黄素转化产物6(t=62min)的核磁氢谱图(1H-NMR)。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围 并不仅限于此:
实施例1:姜黄素衍生物的制备
(1)斜面培养:将库德里阿兹威毕赤酵母ZJPH0802接种至斜面培养基 ,30℃培养3-5天,即得到斜面菌种;所述斜面培养基为麦芽汁培养基 ,终浓度组成为:每升麦芽汁(来源于杭州啤酒厂)中加入20 g琼脂 ,自然pH,121℃灭菌20分钟,灭菌后冷却、制成斜面;
(2)种子培养:从步骤(1)斜面菌体挑取一环菌体接种至装有100 mL种子培养基的250 mL摇瓶中,30℃、200 rpm培养16 h,制备得 到种子液;所述种子培养基终浓度为:葡萄糖25 g/L,酵母膏2.5 g /L,NH4Cl 5.5 g/L,KH2PO4 1 g/L,K2HPO4 1 g/L,MgSO4·7H2O 0.4 g/L, 溶剂为水,pH 6.5,121℃灭菌20分钟,灭菌后冷却;
(3)发酵培养:以体积浓度10%接种量将种子液接种到装有100 mL发 酵培养基的250 mL摇瓶中,30℃、200 rpm培养24 h,得到发酵液 ,离心,收集湿菌体;所述发酵培养基终浓度同步骤(2)种子培养基 终浓度组成;
(4)生物转化:
实验组:将步骤(3)获得的湿菌体用0.1M,pH 6.5的磷酸盐缓冲液 洗涤后,将湿菌体移入0.1 M,pH 6.5的磷酸盐缓冲液中,同时加入 姜黄素底物构成转化体系,姜黄素初始浓度为50 mg/L,湿菌体加量 以菌体干重计为50 g/L。
设置对照组1:将姜黄素加入到0.1M,pH 6.5的磷酸盐缓冲液中,使 其终浓度为50 mg/L,设置对照组2:将步骤(3)获得的湿菌体加入 到0.1M,pH 6.5的磷酸盐缓冲液中,湿菌体加入量以菌体干重计为5 0 g/L。
将各组实验样品在30℃、200 rpm条件下转化反应16 h,反应结束后 ,将转化液离心除去菌体,上清液用乙酸乙酯萃取三次,合并萃取液 ,于50℃减压浓缩至干除去乙酸乙酯,各组浓缩物用色谱甲醇溶解后 待检测。
(5)分析检测
①薄层层析检测(TLC):用毛细点样管分别吸取一定量的实验组样品 、对照组1样品、对照组2样品和姜黄素标准品,分别点样于预活化的 硅胶薄层板上,展层剂为二氯甲烷:甲醇=50:1(v/v),于254 nm紫 外灯下将实验组样品与对照组样品和标准品相比较,采用体积浓度10 %硫酸乙醇溶液喷雾显色后观察是否产生新的斑点。
②高效液相色谱检测(HPLC):所有样品进样检测前先用0.45 μm微 孔滤膜过滤,将实验组样品谱图与对照组1样品、对照组2样品和姜黄 素 标准品进行比对,观察是否出现新的物质峰。
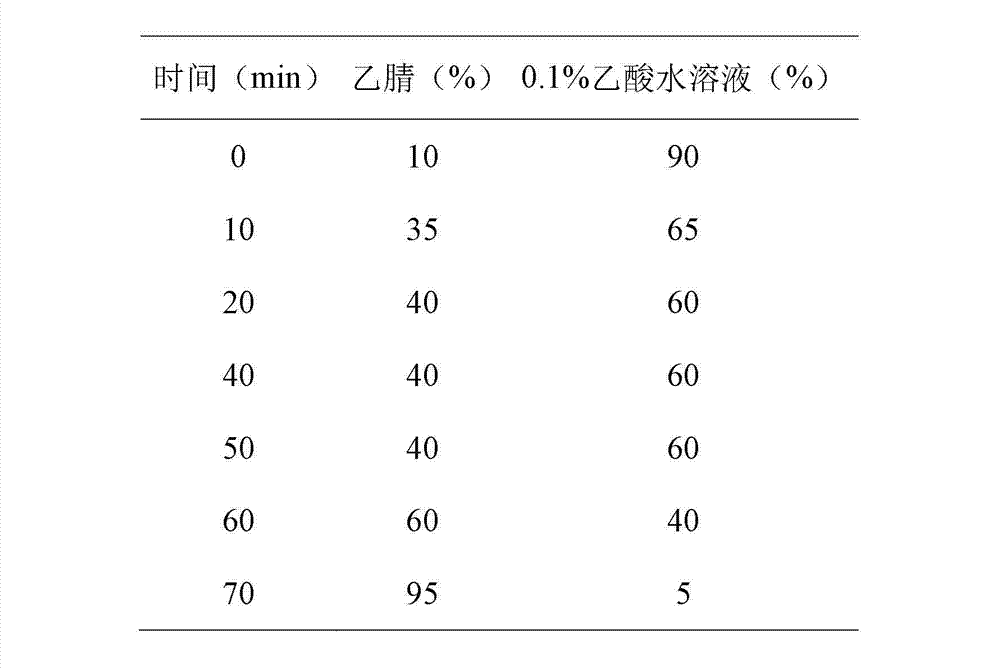
色谱柱为ZORBAX Eclipse XDB-C18(5 μm,250×φ4.6 mm,Agl ient),检测波长:260 nm,流速:0.5 mL/min,进样量:20 μL ,流动相:乙腈-0.1 %乙酸水溶液,梯度洗脱条件如下表1:
表1. HPLC梯度洗脱条件
实验组样品经TLC检测出现两个新的斑点(见图2中的a(Rf值为0.712 )和b(Rf值为0.424)所示),HPLC法检测得到六个微生物转化产物 (图3中的峰1-峰6所示),其中HPLC图谱显示产物3(t=26 min,即 TLC检测时Rf值为0.424时出现的斑点)和产物6(t=62 min,即TLC检 测时Rf值为0.712时出现的斑点)的峰面积较高,含量较多,为库德里 阿兹威毕赤酵母ZJPH0802菌株的两个主要的姜黄素转化产物。
(6)转化产物的分离纯化:
利用硅胶柱层析对上述两个主要的姜黄素转化产物(即转化液经离心 、萃取、减压浓缩后的浓缩物)进行分离。洗脱剂为二氯甲烷:甲醇 (100:1;50:1(v/v))梯度洗脱,硅胶粒径为100-200目,硅胶型号为 粗孔ZCXⅡ;采用湿法装柱,称取60 g硅胶装于直径2 cm的层析柱中 ,上样量(即上述浓缩物)为0.5 g,流速控制在2 mL/min;洗脱液 用TLC跟踪检测,收集Rf值为0.424时的洗脱液,用HPLC法检测纯度( 检测条件同步骤(5)),经过分离纯化,得到产物3(t=26 min); 收集Rf值为0.712 时的洗脱液,用HPLC法检测纯度(检测条件同步骤(5)),经过分离 纯化,得到产物6(t=62min),分别进行LC-MS、1H-NMR和13C-NMR检测 ,并对其进行结构鉴定。
高效液相色谱和质谱联用检测(LC-MS):鞘气流速(arb): 20;辅助 气流速(arb): 20;喷雾电压(kv): 3.5;毛细管温度(℃): 275。
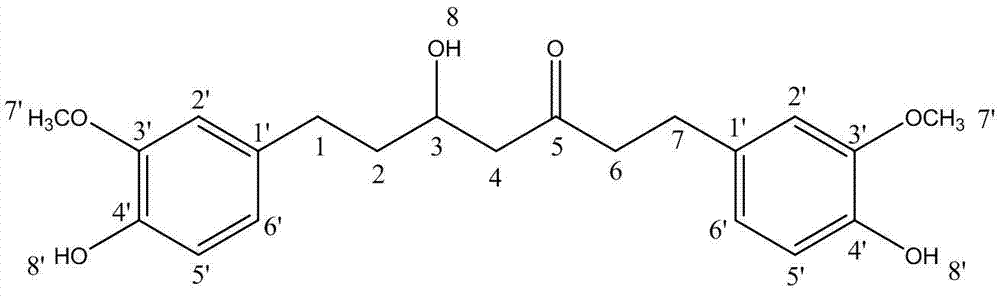
经鉴定,推断该转化产物3(t=26 min)为六氢姜黄素,其结构式为 :
该化合物具有以下理化性质:白色结晶,推断其分子式为C21H26O6。通过 高分辨率的EI-MS得到[M+H+NH3]+ 为392,[M-H]-为373,因此,可推断 出其分子量为374,在(+)EI-MS中,还出现两个主要的分子离子峰, [M+H]+为375, [M+H-H2O]+为357。将m/z 357的分子离子峰断裂,得 到三级质谱(MS3),其m/z分别为339,177,163。如图4和 5所示。 1H-NMR结果为:1H-NMR(MeOD):δ=6.77(2H, s, H-2'); δ=6.70( 2H, dd, H-5'); δ=6.62(2H, d, H-6'); δ=4.02(H, m, H -3); δ=3.84(3H, s, H-OCH3); δ=3.83(3H, s, H-OCH3); δ=2.78(4H, m, H-4,6); δ=2.60(4H, m, H-1,7); δ=1.71( 2H, m, H-2) 如图6所示。
经鉴定,推断转化产物6(t=62 min)为四氢姜黄素,其结构式为:
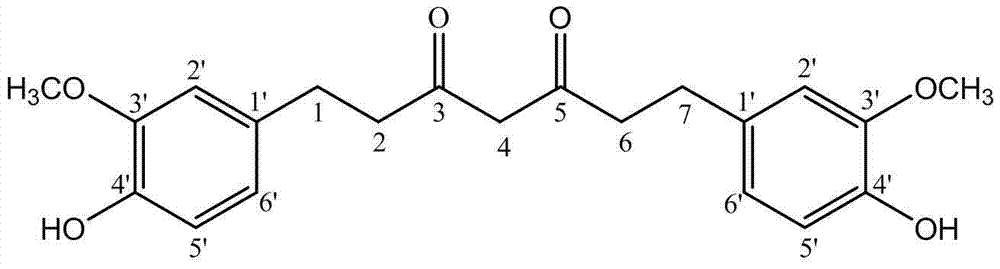
该化合物具有以下理化性质:淡黄色结晶,推断其分子式为C21H24O6, 通过高分辨率的EI-MS得到[M+H]+ 为373,[M-H]-为371,因此,可推 断出其分子量为372,在(+)EI-MS中,还出现一个主要的分子离子峰 ,[M+H-H2O]+为355。将m/z 355的分子离子峰断裂,得到三级质谱( MS3),其m/z分别为219、179、177、163、137,如图7和8所示。1H- NMR结果为:1H-NMR(CDCl3),δ=6.85(2H, d, H-5'); δ=6.70(2H, s, H-2'); δ=6.67(2H, d, H-6'); δ=5.48(2H, m, H-OH ); δ=3.85(6H, s, H-OCH3); δ=3.50(2H, s, H-4); δ=2. 85-2.88(4H, m, H-2,6); δ=2.55-2.58(4H, m, H-1,7),如图 9所示。
据报道(Naito M, Wu X, Nomura H, Kodama M, Kato Y, Kato Y, et al. The protective effects of tetrahydroc urcumin on oxidative stress in cholesterol-fed rabbits . J Atheroscler Thromb 2002;9:243–50; Murugan P, Par i L. Effect of tetrahydrocurcumin on plasma antioxida nts in streptozotocin-nicotinamide experimental diabetes . J Basic Clin Physiol Pharmacol 2006;17:231–44; Mur ugan P, Pari L. Antioxidant effect of tetrahydrocurcu min in streptozotocin-nicotinamide induced diabetic rat s. Life Sci 2006;79:1720–8; Somparn P, Phisalaphong C, Nakornchai S, Unchern S, Morales NP. Comparative antioxidant activities of curcumin and its demethoxy and hydrogenated derivatives. Biol Pharm Bull 2007;30: 74–8.),六氢姜黄素和四氢姜黄素的生物和药理活性都较姜黄素底 物得到了较大的改善,例如:四氢姜黄素的抗LDL氧化的能力高于姜黄 素,且其还能较姜黄素更有效地抑制红细胞膜脂质的过氧化。在患糖 尿病大鼠体内,四氢姜黄素能够比姜黄素更好地调节肾脏和肝脏的功 能,且能够更好地调节血糖浓度和血浆胰岛素水平,因此,四氢姜黄 素比姜黄素具有更好的治疗糖尿病的功效。此外,六氢姜黄素和四氢 姜黄素的抗氧化活性都较姜黄素有所提高,其抗氧化活性顺序为四氢 姜黄素>六氢姜黄素>姜黄素。
实施例2:发酵培养基组分的正交优化
表2 发酵培养基正交因素水平表

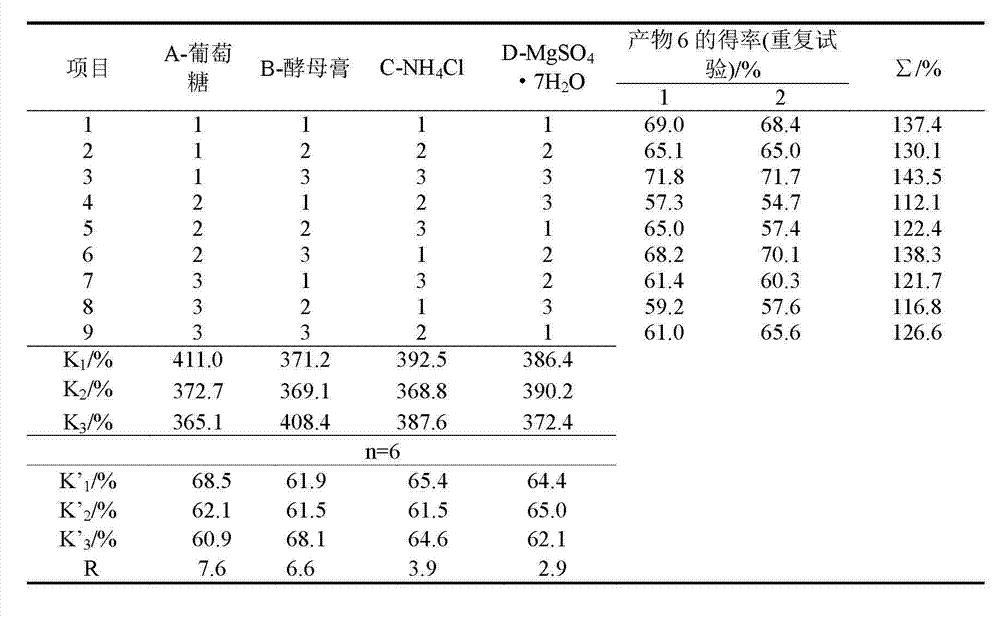
利用库德里阿兹威毕赤酵母(Pichia kudriavzevii) ZJPH0802菌株 ,按实施例1的方法进行斜面培养和种子培养后,按表2设计的试验方 案优化发酵培养基中葡萄糖、酵母膏、NH4Cl和MgSO4·7H2O的浓度。 将发酵后的湿菌体加入装有50 mL 0.1 M,pH 6.5磷酸缓冲液的2 50 mL三角瓶中(湿菌体加入量以菌体干重计为50 g/L),底物姜黄 素浓度为50 mg/L,于30℃,200 rpm转化16 h。反应结束后,离心 除去菌体,得上清液,上清液用乙酸乙酯萃取三次,合并萃取液,于 50℃减压蒸馏除去乙酸乙酯,残留物用色谱甲醇溶解后待检测,根据 面积归一法计算产物6(t=62 min)的产率,结果见表3和表4。
表3 发酵培养基正交试验L9(34)结果
注:K’i= Ki/ n
表4 发酵培养基正交试验方差分析
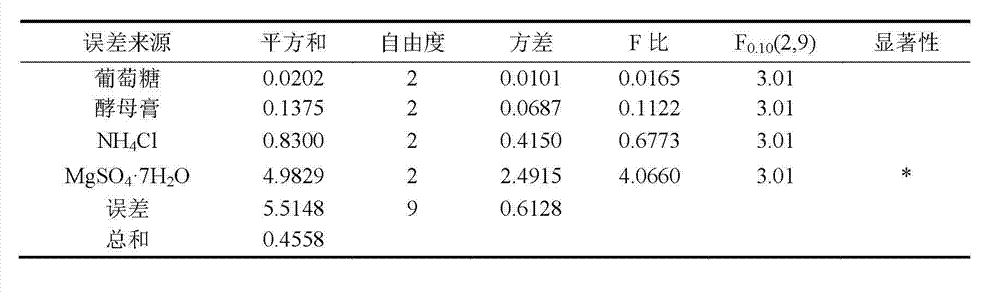
根据方差分析,MgSO4·7H2O是影响产物6(t=62 min)得率较为显著 的因素,根据表3所示,四个因素的最佳配比为A1B3C1D2,即葡萄糖浓 度25 g/L,酵母膏浓度2.5 g/L,NH4Cl浓度5.5 g/L,MgSO4.7H2O 浓度0.4 g/L。当采用此配比的发酵培养基进行培养时,所收获的 菌体对姜黄素转化为产物6的得率达72.4%。
实施例3~ 6 底物浓度对库德里阿兹威毕赤酵母ZJPH0802转化活性的 影响
利用库德里阿兹威毕赤酵母(Pichia kudriavzevii) ZJPH0802菌株 ,按实施例1的方法经发酵培养后,将湿菌体加入装有50 mL 0.1M, pH 6.5磷酸缓冲液的250 mL三角瓶中(湿菌体以菌体干重计为50 g/L),底物姜黄素终浓度分别为20 mg/L、50 mg/L、180 mg/L、 250 mg/L(表5所示),分别于30℃,200 rpm转化16 h。反应结束 后,将转化液离心除去菌体,得上清液,上清液用乙酸乙酯萃取三次 ,合并萃取液,于50℃减压浓缩至干,取浓缩物用色谱甲醇溶解后待 检测,检测方法同实施例1步骤(5),根据面积归一法计算产物6(t =62 min)的得率,结果见表5。
表5 不同底物浓度对转化产物6(t=62 min)得率的影响

结论:由表5可知,较佳的底物质量浓度为50 mg/L。
实施例7~ 10 菌体浓度对库德里阿兹威毕赤酵母ZJPH0802转化活性 的影响
利用库德里阿兹威毕赤酵母(Pichia kudriavzevii) ZJPH0802菌株 ,按实施例1的方法经发酵培养后,将湿菌体加入装有50 mL 0.1M, pH 6.5磷酸缓冲液的250 mL三角瓶中(湿菌体以菌体干重计为20 g/L、50 g/L、100 g/L和150 g/L)(表6所示),底物姜黄素终浓 度分别为50 mg/L,分别于30℃,200 rpm转化16 h。反应结束后, 将转化液离心除去菌体,得上清液,上清液用乙酸乙酯萃取三次,合 并萃取液,于50℃减压浓缩至干,取浓缩物用色谱甲醇溶解后待检测 ,检测方法同实施例1步骤(5),根据面积归一法计算产物6(t=62 min)的得率,结果见表6。
表6 不同菌体浓度对库德里阿兹威毕赤酵母ZJPH0802转化活性的影响
结论:从表6可知,较佳的菌体浓度为50 g/L。
实施例11~16 pH值对库德里阿兹威毕赤酵母ZJPH0802转化活性的影 响
利用库德里阿兹威毕赤酵母(Pichia kudriavzevii) ZJPH0802菌株 ,按实施例1的方法经发酵培养后,将湿菌体加入装有50 mL 0.1M, pH 分别为5.8~8.0磷酸缓冲液(表7所示)的250 mL三角瓶中(湿菌 体终浓度为50 g/L),底物姜黄素浓度为50 mg/L,于30℃,200 rpm转化16 h。反应结束后,离心除去菌体,得上清液,上清液用乙 酸乙酯萃取三次,合并萃取液,减压浓缩至干除去乙酸乙酯,取浓缩 物用色谱甲醇溶解后待检测,检测方法同实施例1步骤(5),根据面 积归一法计算产物6(t=62 min)的得率,结果见表7。
表7 不同pH对转化产物6(t=62 min)得率的影响
结论:从表7可以看出,较佳的pH为6.5。
实施例17~20 转化温度对库德里阿兹威毕赤酵母ZJPH0802转化活性 的影响
利用库德里阿兹威毕赤酵母(Pichia kudriavzevii) ZJPH0802菌株 ,按实施例1的方法经发酵培养后,将湿菌体加入装有50 mL 0.1M, pH 6.5磷酸缓冲液的250 mL三角瓶中(湿菌体终浓度为50 g/L), 底物姜黄素浓度为50 mg/L,于25~40℃(表8所示),200 rpm转化 16 h。反应结束后,离心除去菌体,得上清液,上清液用乙酸乙酯萃 取三次,合并萃取液,减压浓缩至干除去乙酸乙酯,取浓缩物用色谱 甲醇溶解后待检测,检测方 法同实施例1步骤(5),根据面积归一法计算产物6(t=62 min)的 得率,结果见表8。
表8 不同转化温度对转化产物6(t=62 min)得率的影响
结论:由表8可知,较佳的转化温度为30℃。
实施例21~24 摇床转速对库德里阿兹威毕赤酵母ZJPH0802转化活性 的影响
利用库德里阿兹威毕赤酵母(Pichia kudriavzevii) ZJPH0802菌株 ,按实施例1的方法经发酵培养后,将湿菌体加入装有50 mL 0.1M, pH 6.5磷酸缓冲液的250 mL三角瓶中(湿菌体终浓度为50 g/L), 底物姜黄素浓度为50 mg/L,于30℃,150~220 rpm(表9所示)转化 16 h。反应结束后,离心除去菌体,得上清液,上清液用乙酸乙酯萃 取三次,合并萃取液,减压浓缩至干除去乙酸乙酯,取浓缩物用色谱 甲醇溶解后待检测,检测方法同实施例1步骤(5),根据面积归一法 计算产物6(t=62 min)的得率,结果见表9。
表9 不同摇床转速对转化产物6(t=62 min)得率的影响
结论:从表9可知,较佳的摇床转速为200 rpm。
实施例25~31 转化时间对库德里阿兹威毕赤酵母ZJPH0802转化活性的 影响
利用库德里阿兹威毕赤酵母(Pichia kudriavzevii) ZJPH0802菌株 ,按实施例1的方法经发酵培养后,将湿菌体加入装有50 mL 0.1M, pH 6.5磷酸缓冲液的250 mL三角瓶中(湿菌体终浓度为50 g/L), 底物姜黄素浓度为50 mg/L,于30℃,200 rpm转化2~24 h(表10所 示)。反应结束后,离心除去菌体,得上清液,上清液用乙酸乙酯萃 取三次,合并萃取液,减压浓缩至干,除去乙酸乙酯,取浓缩物用色 谱甲醇溶解后待检测,检测方法同实施例1步骤(5),根据面积归一 法计算产物6(t=62 min)的得率,结果见表10。
表10 不同转化时间对转化产物6(t=62 min)得率的影响
结论:由表10可知,较佳的转化时间为16 h。
SEQUENCE LISTING
<110> 浙江工业大学
<120> 库德里阿兹威毕赤酵母ZJPH0802及其在制备姜黄素衍生物中的应用
<130>
<160> 1
<170> PatentIn version 3.5
<210> 1
<211> 581
<212> DNA
<213> Pichia kudriavzevii
<400> 1
gcggaggaaa agaaaccaac agggattgcc tcagtagcgg cgagtgaagc ggcaagagct 60
cagatttgaa atcgtgcttt gcggcacgag ttgtagattg caggttggag tctgtgtgga 120
aggcggtgtc caagtccctt ggaacagggc gcccaggagg gtgagagccc cgtgggatgc 180
cggcggaagc agtgaggccc ttctgacgag tcgagttgtt tgggaatgca gctccaagcg 240
ggtggtaaat tccatctaag gctaaatact ggcgagagac cgatagcgaa caagtactgt 300
gaaggaaaga tgaaaagcac tttgaaaaga gagtgaaaca gcacgtgaaa ttgttgaaag 360
ggaagggtat tgcgcccgac atggggattg cgcaccgctg cctctcgtgg gcggcgctct 420
gggctttccc tgggccagca tcggttcttg ctgcaggaga aggggttctg gaacgtggct 480
cttcggagtg ttatagccag ggccagatgc tgcgtgcggg gaccgaggac tgcggccgtg 540
taggtcacgg atgctggcag aacggcgcaa caccgcccgt c 581




 手机二维码
手机二维码 京公网安备11011302007134
京公网安备11011302007134